(CRISTINA JEWETT. THE NEW YORK TIMES)
Hoy en día existen programas de inteligencia artificial que escanean resonancias magnéticas en busca de signos de cáncer, AirPods de Apple que funcionan como audífonos y dispositivos que decodifican las señales eléctricas del cerebro para restaurar el habla a quienes la han perdido.
La tecnología de los dispositivos médicos está hoy profundamente arraigada en la atención médica de muchos pacientes y puede tener un impacto asombroso en sus vidas. A medida que los avances se vuelven más tangibles para millones de estadounidenses, la regulación de los dispositivos ha atraído cada vez más atención en la Administración de Alimentos y Medicamentos.
La Dra. Michelle Tarver, una veterana de 15 años de la agencia, está entrando en ese centro de atención en un momento crítico. Está tomando las riendas de la división de dispositivos de la FDA de manos del Dr. Jeffrey Shuren, quien forjó vínculos profundos con la industria de dispositivos, aceleró el ritmo de las aprobaciones e hizo que la agencia fuera más accesible para las empresas. Algunos de esos fabricantes de dispositivos estaban representados por la esposa del Dr. Shuren y su bufete de abogados, lo que le planteó conflictos éticos que siguen siendo objeto de escrutinio.
En términos más generales, los legisladores del Congreso y los defensores de los consumidores están cada vez más preocupados por la influencia de la industria de los dispositivos sobre la extensa división, que tiene un presupuesto de unos 790 millones de dólares y una plantilla de 2.500 personas. La seguridad de los dispositivos y las normas para las aprobaciones de productos tan íntimos como las válvulas cardíacas o los implantes neuronales estarán al frente de la misión de la división en los próximos años. Entre los problemas que el Dr. Tarver encontrará:
Cerebros, computadoras y Elon Musk
Pocos dispositivos requerirán una supervisión tan intensa como una de las tecnologías más impresionantes en desarrollo: interfaces cerebro-computadora que se sumergen en las capas superficiales del cerebro para decodificar su ruido eléctrico y devolver la función a las personas que la han perdido.
Investigadores de varios equipos han demostrado la capacidad de restaurar la voz y el habla de un hombre de California con ELA, permitir que un hombre paralizado camine y ayudar a un hombre paralizado del cuello a jugar al Mario Kart simplemente pensando en girar a la izquierda o a la derecha.
La división de dispositivos médicos está desempeñando un papel crucial en este campo al autorizar y supervisar los ensayos que evalúan la seguridad y eficacia de los dispositivos y, en algún momento en el futuro, decidir si pueden venderse.
Quizás ninguna empresa que desarrolle un dispositivo tenga más perfil que Neuralink, del multimillonario Elon Musk. La empresa está desarrollando el dispositivo cerebro-computadora que permitió a un hombre de Arizona jugar videojuegos con su mente. Neuralink también está empezando a trabajar en un dispositivo que Musk espera que pueda restaurar la visión.
“La sobrerregulación mata gente”, dijo Musk a una audiencia en Pittsburgh a principios de este mes, y agregó que “simplemente acelerar las aprobaciones de medicamentos en la FDA, creo, salvará millones de vidas”.
Neuralink ya ha recibido luz verde de la agencia para implantar su dispositivo, que se inserta en un agujero de un cuarto de ancho perforado en el cráneo, en un segundo paciente .
Dependiendo del resultado de las elecciones presidenciales, Musk podría ganar una influencia considerable en varias agencias federales que supervisan sus negocios , incluidas Tesla, SpaceX y presumiblemente Neuralink, lo que podría darle ventaja sobre sus competidores.

El peso de la influencia de la industria
Otro crítico de la agencia, Robert F. Kennedy Jr., se ha sumado a la campaña de Trump y ha hecho pública su oposición a muchas de las obligaciones regulatorias de la FDA. Ha sido excepcionalmente franco en cuanto a la financiación de la agencia, denunciando los acuerdos que canalizan miles de millones de dólares de dinero de la industria hacia la agencia. No se equivoca : las llamadas tarifas de usuario de la industria representan aproximadamente la mitad del presupuesto de la FDA.
Se espera que en dos años, el Dr. Tarver tome la iniciativa en la próxima serie de negociaciones de alto riesgo que determinarán cómo la FDA gasta miles de millones de dólares recaudados de las industrias de medicamentos y dispositivos que la agencia regula.
Las negociaciones han adquirido mayor importancia para la FDA: los fondos de la industria aportan ahora 362 millones de dólares, o casi la mitad del presupuesto de la división de dispositivos, de 790 millones de dólares, y un pago general que equivale a casi la mitad del presupuesto anual de la agencia, de 7.200 millones de dólares.
El proceso es similar a las Olimpiadas de la formulación de políticas para la FDA, que culminan en acuerdos que deben ser aprobados por el Congreso para que la agencia siga funcionando. Los fondos respaldan la contratación de cientos de empleados de la agencia que tienen la misión de mantener un ritmo rápido de revisiones de productos.
El acuerdo tiene sus partidarios, que señalan que el dinero permite a la FDA ser competitiva en la contratación de científicos que puedan seguir el ritmo del rápido flujo de innovación en biotecnología y otros campos. Pero también ha suscitado críticas por la preocupación de que pone a la FDA a trabajar para industrias mayoritariamente con fines de lucro y compromete los esfuerzos de la agencia por proteger la salud pública.
Problemas éticos persistentes
Esas preocupaciones se hacen más evidentes ahora que el Dr. Tarver asume el puesto del director saliente de la división de dispositivos, el Dr. Shuren. Ha supervisado y participado en el proceso de negociación con un cliente legal de su esposa, que a menudo está en la mesa de negociaciones, según descubrió The New York Times.
Una investigación del Times publicada en agosto concluyó que el Dr. Shuren no había respetado las normas éticas de la agencia en algunos casos en que su trabajo coincidía con el de su esposa, Allison Shuren, una destacada abogada de la oficina de Arnold & Porter en Washington, DC. Los hallazgos llevaron a los legisladores a solicitar una revisión por parte del inspector general del Departamento de Salud y Servicios Humanos.
Uno de los clientes de la Sra. Shuren en los últimos años ha sido Alcon, un gigante del cuidado ocular que fabrica dispositivos médicos, incluidos lentes implantados en el ojo y láseres utilizados en cirugía ocular.
Durante las reuniones de tarifas para usuarios en 2021, los ejecutivos de Alcon negociaron con la FDA en nombre de dos grupos comerciales de dispositivos médicos que representan a cientos de empresas. Fue la única empresa que envió dos representantes, a pesar de que es mucho más pequeña que otras, como Medtronic y Johnson & Johnson, que estaban en la mesa.
El Dr. Shuren negoció en persona con Alcon y otras empresas en 2016, según muestran los registros de la agencia. Después de cada ciclo de conversaciones, el Dr. Shuren presentó el acuerdo al Congreso , según las transcripciones de su testimonio a la agencia.
Las leyes federales de ética prohíben a los funcionarios trabajar en asuntos gubernamentales en los que un cónyuge tenga un interés financiero que afecte a una empresa o a un grupo discreto. La FDA ha dicho que el Dr. Shuren “no ha participado en asuntos específicos de Alcon”. Cuando se le preguntó si la agencia tenía inquietudes sobre la posibilidad de que se produjeran conflictos éticos y financieros dada la participación del Dr. Shuren en las conversaciones, la agencia se negó a hacer comentarios. El Dr. Shuren y la Sra. Shuren no respondieron a las solicitudes de comentarios.
Steven Smith, portavoz de Alcon, no respondió directamente a las preguntas y dijo que “los compromisos inquebrantables con la salud y la seguridad del paciente y la integridad corporativa guían cada acción que tomamos”.
Los expertos en ética dijeron que incluso si el Dr. Shuren no se hubiera centrado en las políticas específicas de Alcon, debería haber considerado la apariencia de parcialidad a favor del cliente de un cónyuge durante una negociación de amplio alcance.
“El trabajo de un funcionario federal es infundir confianza en el gobierno”, dijo Richard Painter, profesor de derecho de la Universidad de Minnesota y ex abogado de ética federal.
Entre los acuerdos alcanzados en los últimos años se incluye el compromiso de la FDA de decidir las aprobaciones del 95 por ciento de los dispositivos de riesgo bajo a moderado en un plazo de 90 días. Otro acuerdo condujo a un programa de revisión por terceros que permite a las empresas externas tomar decisiones iniciales sobre la aprobación de productos y dispositivos, que son finalizadas por la agencia.
El campo de la IA en expansión
El rápido ritmo de autorizaciones de productos ha puesto la división bajo escrutinio tanto en los sectores más tradicionales de la medicina como en los más avanzados.
Recientemente, investigadores de Harvard analizaron decenas de retiradas de dispositivos de cardiología y descubrieron que la FDA había considerado que muchos de ellos presentaban un riesgo moderado, aunque resultaron ser mortales. Un editorial del Dr. Ezekiel Emmanuel, ex funcionario federal de salud y vicerrector de la Universidad de Pensilvania, acompañó el artículo y pidió a la FDA que priorizara la seguridad por sobre la velocidad.
La FDA dijo que no estaba de acuerdo con una afirmación del estudio de que los dispositivos similares a los que ya se comercializan necesitan ser probados exhaustivamente en personas.
Los médicos e investigadores que examinan los programas de inteligencia artificial aprobados por la agencia también han descubierto deficiencias en los registros de revisión de la agencia. Cuando consideran el uso de dichas herramientas en la atención al paciente, muchas de las respuestas que buscan sobre cómo funcionan los programas no se encuentran en los registros de aprobación de la agencia.
La gran mayoría de esos programas se consideran de riesgo bajo o moderado, y cientos de ellos han sido autorizados en virtud del programa 510(K) de la agencia, en el que los productos suelen autorizarse en 90 días. Entre ellos se incluyen programas informáticos destinados a detectar cánceres y otros problemas en imágenes por resonancia magnética, tomografías computarizadas y otras técnicas de diagnóstico por imagen.
En octubre, investigadores de Stanford publicaron un estudio en el que se señalaba que una gran mayoría (el 96 por ciento de casi 700) de los programas de inteligencia artificial autorizados por la FDA no tenían información sobre raza o etnia, “lo que agrava el riesgo de sesgo algorítmico y disparidad en la salud”.
Investigadores del Mass General Brigham y de otros lugares publicaron un informe que concluía que la información de la FDA sobre el desempeño de ciertos programas era demasiado escasa para justificar su uso en la práctica médica.
Aun así, la promesa de la IA en la atención médica ha generado un gran interés, y la FDA ha discutido su uso en el desarrollo de medicamentos y su empleo interno para detectar “trampas” en las aplicaciones de productos, dijo el Dr. Robert Califf, comisionado de la agencia, en un discurso en una conferencia en Las Vegas en octubre.
El Dr. Shuren ha dicho a menudo que el marco regulatorio para los dispositivos médicos fue desarrollado para una tecnología que data de la época de su abuela, hace casi 50 años.
En ese evento de Las Vegas, el Dr. Califf reconoció las limitaciones de la agencia para regular el amplio alcance de los programas de IA, incluido su funcionamiento cuando se implementan ampliamente. La evaluación del alcance de los programas de IA va mucho más allá de la agencia, afirmó.
“Es muy grave”, explicó. “Si dijéramos: ‘Bueno, la FDA tiene que vigilar el 100 por ciento de esto’, necesitaríamos una FDA dos o tres veces más grande de lo que es actualmente”.
Christina Jewett cubre la Administración de Alimentos y Medicamentos, lo que significa que sigue de cerca los medicamentos, los dispositivos médicos, la seguridad alimentaria y las políticas sobre tabaco.
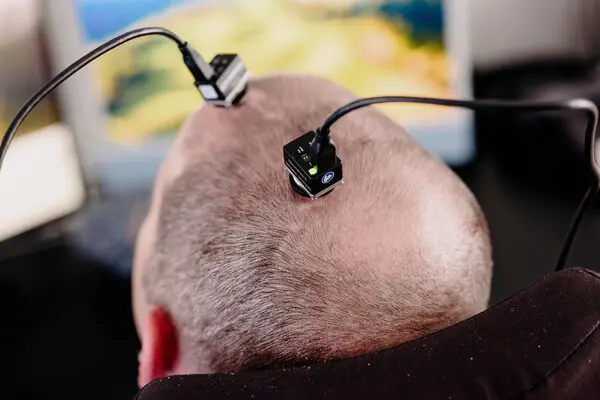
Un implante cerebral que ha permitido a su usuario, Casey Harrell, de California, que padece ELA, poder hablar con la ayuda de una voz de computadora impulsada por IA. Blackrock Neurotech fabricó el dispositivo con fines de investigación.Crédito…Ian C. Bates para The New York Times
